细胞凋亡检测可以:
用于肿瘤细胞和组织在内的不同种类病理标本研究;
应用于临床诊疗,新药研制、生物制品开发、肿瘤放化疗、以及从促凋亡角度探索肿瘤的基因治疗;
对相关疾病的早期发现、放化疗的疗效评价具有举足轻重的地位。
细胞凋亡的检测方法有很多,下面介绍 7 种常用的测定方法。
1
形态学检测法
实验方法原理
根据凋亡细胞固有的形态特征,使用合适的显微镜检测凋亡细胞形态变化。
光学显微镜和倒置显微镜
(1)未染色细胞:凋亡细胞的体积变小、变形,细胞膜完整但出现发泡现象,细胞凋亡晚期可见凋亡小体。贴壁细胞出现皱缩、变圆、脱落。
(2)染色细胞:常用姬姆萨染色、瑞氏染色等。凋亡细胞的染色质浓缩、边缘化,核膜裂解、染色质分割成块状和凋亡小体等典型的凋亡形态。
荧光显微镜和共聚焦激光扫描显微镜
一般以细胞核染色质的形态学改变为指标来评判细胞凋亡的进展情况。
常用的 DNA 特异性染料有:HO 33342 (Hoechst 33342),HO 33258 (Hoechst 33258),DAPI。三种种染料与 DNA 的结合是非嵌入式的,主要结合在 DNA 的 A-T 碱基区。紫外光激发时发射明亮的蓝色荧光。
Hoechst 是与 DNA 特异结合的活性染料,储存液用蒸馏水配成 1 mg/ml 的浓度,使用时用 PBS 稀释,终浓度为 10 ug/ml。
DAPI 为半通透性,用于常规固定细胞的染色。储存液用蒸馏水配成 1 mg/ml 的浓度,使用终浓度一般为 10 ug/ml。
结果评判:细胞凋亡过程中细胞核染色质的形态学改变分为三期:Ⅰ期的细胞核呈波纹状(rippled)或呈折缝样(creased),部分染色质出现浓缩状态;Ⅱa 期细胞核的染色质高度凝聚、边缘化;Ⅱb 期的细胞核裂解为碎块,产生凋亡小体 (图 1)。

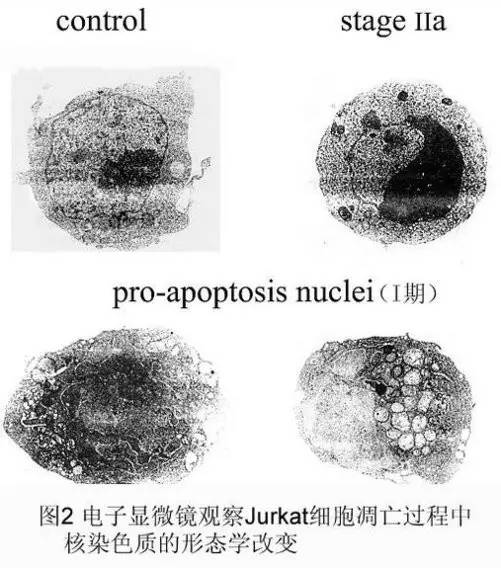
透射电子显微镜观察
结果评判:凋亡细胞体积变小,细胞质浓缩。凋亡Ⅰ期(pro-apoptosis nuclei)的细胞核内染色质高度盘绕,出现许多称为气穴现象(cavitations)的空泡结构 (图 2);Ⅱa 期细胞核的染色质高度凝聚、边缘化;细胞凋亡的晚期,细胞核裂解为碎块,产生凋亡小体。
2
磷脂酰丝氨酸外翻分析(Annexin-V)法态学
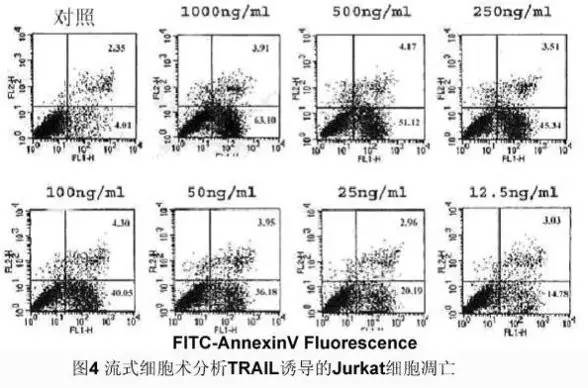
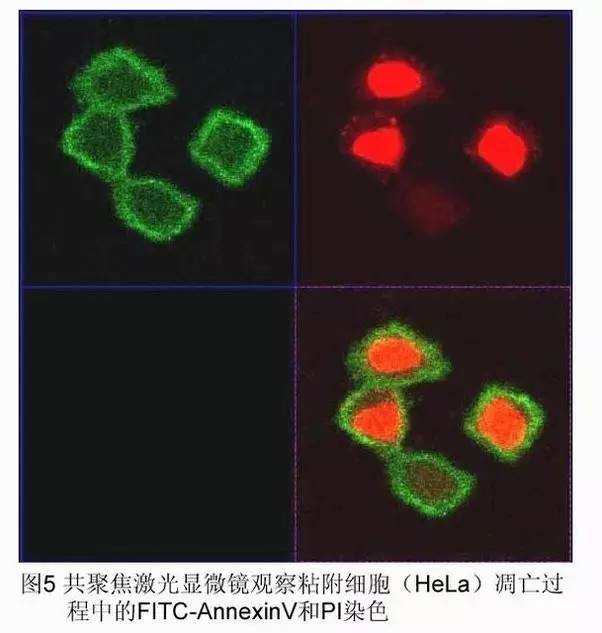
磷脂酰丝氨酸(Phosphatidylserine,PS)正常位于细胞膜的内侧,但在细胞凋亡的早期,PS 可从细胞膜的内侧翻转到细胞膜的表面,暴露在细胞外环境中 (图 3)。Annexin-V 是一种分子量为 35~36 KD 的 Ca2+依赖性磷脂结合蛋白,能与 PS 高亲和力特异性结合。将 Annexin-V 进行荧光素(FITC、PE)或 biotin 标记,以标记了的 Annexin-V 作为荧光探针,利用流式细胞仪或荧光显微镜可检测细胞凋亡的发生。

碘化丙啶 (propidine iodide,PI) 是一种核酸染料,它不能透过完整的细胞膜,但在凋亡中晚期的细胞和死细胞,PI 能够透过细胞膜而使细胞核红染。因此将 Annexin-V 与 PI 匹配使用,就可以将凋亡早晚期的细胞以及死细胞区分开来。
实验步骤
悬浮细胞的染色
将正常培养和诱导凋亡的悬浮细胞(0.5~1×106)用 PBS 洗 2 次,加入 100 ul Binding Buffer 和 FITC 标记的 Annexin-V(20 ug/ml)10 ul,室温避光 30 min,再加入 PI(50 ug/ml)5 ul,避光反应 5 min 后,加入 400 ul Binding Buffer,立即用 FACScan 进行流式细胞术定量检测(一般不超过 1 h), 同时以不加 AnnexinV-FITC 及 PI 的一管作为阴性对照。
贴壁培养的细胞染色
先用 0.25% 的胰酶消化,洗涤、染色和分析同悬浮细胞。
爬片细胞染色
同上,最后用荧光显微镜和共聚焦激光扫描显微镜进行观察。
结果